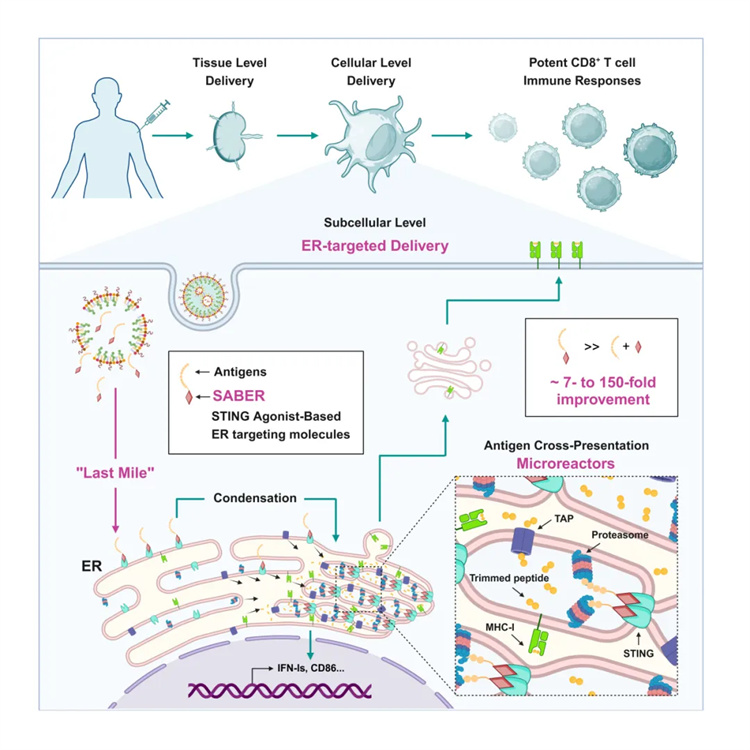
當(dāng)前,抗原交叉提呈增強(qiáng)策略主要聚焦于組織和細(xì)胞層面的遞送,而對于亞細(xì)胞層面的精準(zhǔn)靶向和調(diào)控極少研究。
在傳統(tǒng)的以外源蛋白作為免疫原的疫苗中,進(jìn)入人體的抗原經(jīng)抗原提呈細(xì)胞吞噬后,需要先逃出溶酶體,進(jìn)入細(xì)胞質(zhì),然后被轉(zhuǎn)運至內(nèi)質(zhì)網(wǎng)進(jìn)行加工處理,進(jìn)而經(jīng)MHC-I分子展示在細(xì)胞表面提醒免疫系統(tǒng)。
在上述過程中,有多少抗原可以順利到達(dá)內(nèi)質(zhì)網(wǎng)?到達(dá)內(nèi)質(zhì)網(wǎng)的抗原蛋白數(shù)量是否是抗原交叉提呈的限速步驟?這些問題目前尚不清晰。開發(fā)一種低免疫原性的高效內(nèi)質(zhì)網(wǎng)靶向分子,以精準(zhǔn)調(diào)控抗原在細(xì)胞質(zhì)中的遞送路徑,進(jìn)而提升抗原交叉提呈效率,成為當(dāng)前研究領(lǐng)域的需求和熱點之一。
北京時間2025年3月27日0點,復(fù)旦大學(xué)基礎(chǔ)醫(yī)學(xué)院陸路、姜世勃團(tuán)隊聯(lián)合中山大學(xué)附屬第一醫(yī)院王驥研究員團(tuán)隊、遼寧大學(xué)生命科學(xué)院曾穎玥副教授團(tuán)隊,在《自然》(Nature)雜志以Article形式在線發(fā)表了題為"STING agonist-based ER targeting molecules boost antigen cross-presentation"的研究論文。
該研究開發(fā)了基于干擾素基因刺激蛋白(STING)激動劑的高親和力內(nèi)質(zhì)網(wǎng)靶向分子(SABER),它能有效地將抗原在細(xì)胞內(nèi)部遞送至內(nèi)質(zhì)網(wǎng),并通過折疊、重塑內(nèi)質(zhì)網(wǎng)膜使其聚集,形成包含膜相關(guān)蛋白酶體、STING相關(guān)抗原和抗原轉(zhuǎn)運體的“微反應(yīng)器”。此外,作者還通過腫瘤疫苗和傳染病疫苗兩種模型,證明了針對抗原交叉提呈細(xì)胞內(nèi)從細(xì)胞質(zhì)到內(nèi)質(zhì)網(wǎng)的“最后一公里”的精確靶向可以大幅提升疫苗免疫效果。

為抗原遞送修建“纜車”
在傳染病疫苗和癌癥免疫治療研發(fā)中,誘導(dǎo)強(qiáng)大的CD8+ T細(xì)胞免疫應(yīng)答是關(guān)鍵目標(biāo)之一。蛋白類疫苗中的免疫原主要依靠MHC-I類分子進(jìn)行抗原交叉提呈,從而有效誘發(fā)CD8+ T細(xì)胞免疫應(yīng)答。上述過程主要在樹突狀細(xì)胞(DC)的內(nèi)質(zhì)網(wǎng)上發(fā)生。然而,抗原交叉提呈的效率低下一直是限制疫苗效果的瓶頸之一。目前大量研究主要集中于組織和細(xì)胞層面的靶向遞送,而細(xì)胞內(nèi)部的亞細(xì)胞層面的抗原靶向遞送主要局限于促進(jìn)抗原從溶酶體逃逸。如何有效地將細(xì)胞質(zhì)中的抗原遞送至交叉提呈的主要場所——內(nèi)質(zhì)網(wǎng),一直是該領(lǐng)域內(nèi)關(guān)注的科學(xué)難題之一。
該成果是團(tuán)隊2020年合作發(fā)表于《科學(xué)》(Science)主刊的研究成果的延續(xù),當(dāng)時的研究主要研發(fā)了基于仿生納米顆粒的新型免疫增強(qiáng)佐劑技術(shù),為研制廣譜抗流感病毒的通用疫苗提供了新思路。打個通俗的比方,提升疫苗免疫效果好比人爬山登頂?shù)倪^程,2020年的成果聚焦于把人送達(dá)山腳下(從呼吸道遞送到肺泡上皮細(xì)胞),而此次的研究成果則進(jìn)一步提供助力,修建了一條通達(dá)山頂?shù)?ldquo;纜車”,在細(xì)胞內(nèi)部的亞細(xì)胞層面完成抗原靶向遞送(在細(xì)胞質(zhì)中高效送達(dá)內(nèi)質(zhì)網(wǎng)),打通登山的“最后一公里”。

在兩種模型中完成驗證
打通“最后一公里”的難度不亞于先前送達(dá)山腳下的過程,近年來,合作團(tuán)隊從天然免疫分子STING蛋白切入,改造了靶向STING蛋白的小分子激動劑,合成了一系列高親和力的內(nèi)質(zhì)網(wǎng)靶向分子SABER。該分子的設(shè)計可以實現(xiàn)雙重功能:一是通過偶聯(lián)表位多肽,將抗原靶向內(nèi)質(zhì)網(wǎng),形成局部高濃度的抗原以及抗原提呈關(guān)鍵酶富集區(qū),促進(jìn)交叉提呈;二是SABER仍保留了STING激動劑的功能,可顯著激活先天免疫系統(tǒng),發(fā)揮佐劑效應(yīng)。利用該技術(shù),團(tuán)隊先后評估了疫苗佐劑在抗腫瘤免疫和抗極易變異的病毒(如冠狀病毒)感染中的作用。
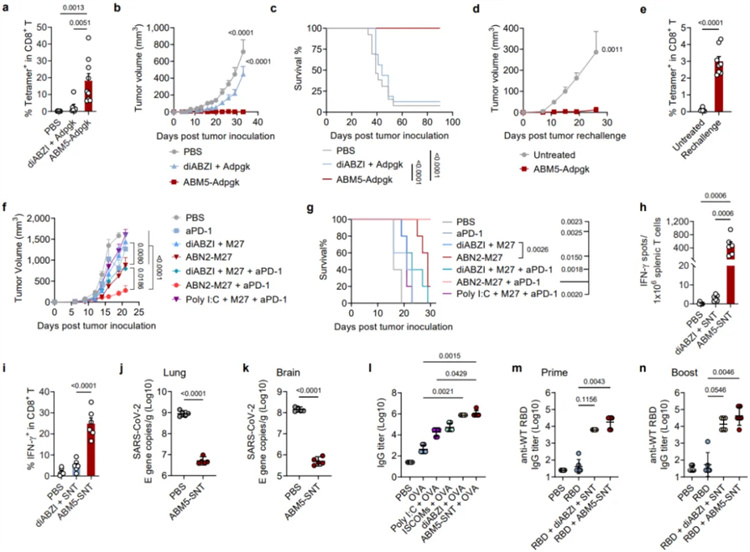
為了評估SABER疫苗設(shè)計增強(qiáng)的CD8+ T細(xì)胞應(yīng)答在抗腫瘤免疫中的作用,作者從一系列對ABM5-OVA(羧基端偶聯(lián)卵清蛋白(OVA)多肽的一種SABER分子)二次免疫后14天的小鼠進(jìn)行表達(dá)OVA的黑色素瘤B16F10(B16-OVA)接種。結(jié)果表明,ABM5-OVA 疫苗接種顯著抑制小鼠腫瘤生長,并且使所有小鼠免于死亡。接種對照佐劑疫苗diABZI+ OVA只能適度減緩腫瘤生長,并且約90%的小鼠在5周內(nèi)死亡。除了疫苗的預(yù)防作用外,ABM5-OVA還可以在上述腫瘤模型中作為治療性疫苗使用。相比于對照佐劑疫苗,它能夠長時間(7周)抑制腫瘤生長。此外,研究團(tuán)隊還在表達(dá)OVA的惡性T細(xì)胞淋巴瘤E.G7-OVA上證明了該疫苗設(shè)計策略的有效性。
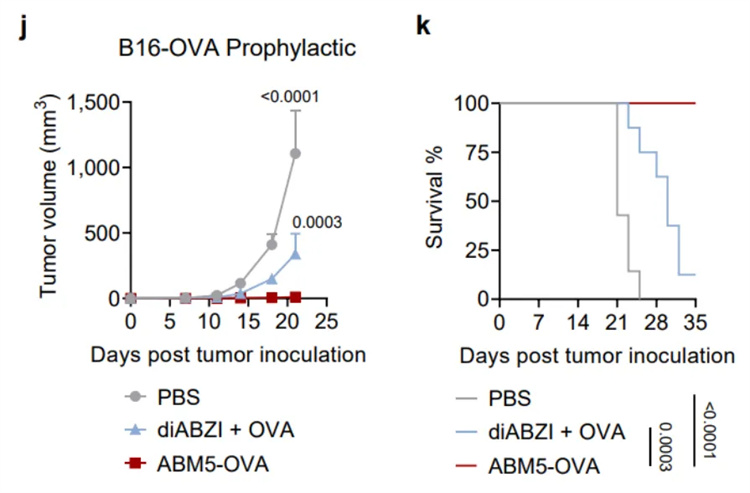
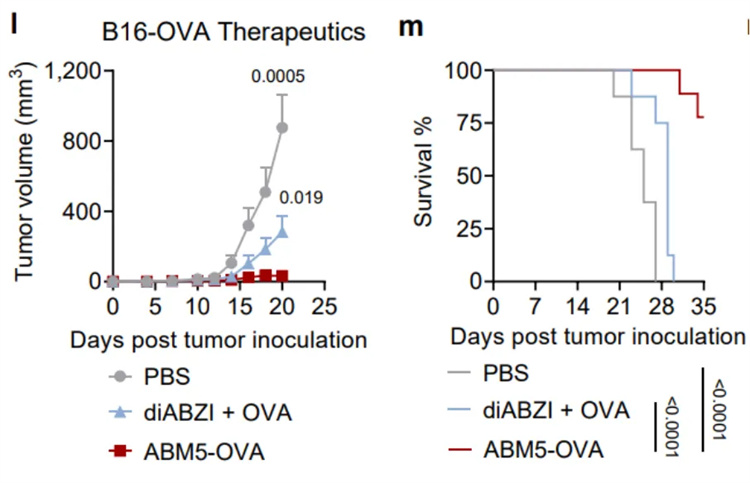
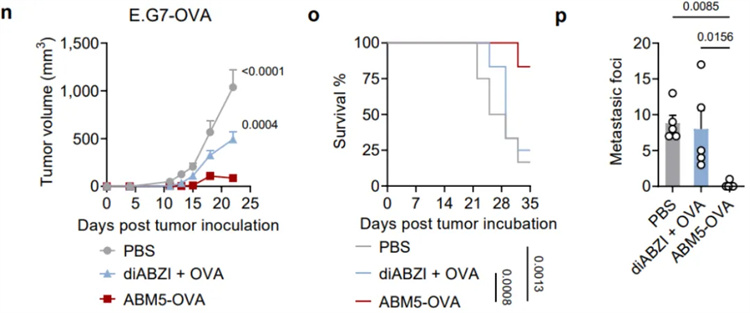
SABER偶聯(lián)的抗原激發(fā)了強(qiáng)大的抗腫瘤免疫應(yīng)答
為了進(jìn)一步驗證SABER偶聯(lián)真正的腫瘤抗原對CD8+ T細(xì)胞應(yīng)答激活和抗腫瘤免疫的有效性,研究團(tuán)隊將ABM5與來自突變的ADP依賴性葡萄糖激酶(Adpgk,一種腫瘤新生抗原)中的一段多肽連接并封裝至脂質(zhì)納米顆粒(LNP)中,制備疫苗進(jìn)行小鼠免疫。結(jié)果表明,ABM5-Adpgk可誘導(dǎo)針對上述腫瘤新生抗原的強(qiáng)效且特異性CD8+ T細(xì)胞應(yīng)答,并且其應(yīng)答水平比接受模擬疫苗和diABZI與Adpgk混合疫苗免疫的小鼠分別高出150倍和7倍。并且,免疫三針ABM5-Adpgk可以實現(xiàn)MC38結(jié)直腸癌小鼠持續(xù)90天無瘤生存。
除了腫瘤疫苗之外,研發(fā)能夠誘導(dǎo)有效的CD8+ T細(xì)胞應(yīng)答的疫苗對于保護(hù)人類免于極易變異的病毒(如冠狀病毒)感染也有重要意義。為了實現(xiàn)這一目標(biāo),研究團(tuán)隊以SARS-CoV-2為模型開展了研究。首先將ABM5與病毒N蛋白中的保守T細(xì)胞表位(第130-149為氨基酸)連接,并使用LNP包裹免疫小鼠。結(jié)果表明,ABM5-SNT能夠誘導(dǎo)強(qiáng)大的抗原特異性T細(xì)胞免疫應(yīng)答。隨后,為了進(jìn)一步驗證該疫苗誘導(dǎo)的CD8+ T細(xì)胞應(yīng)答在預(yù)防病毒感染中的功能,研究團(tuán)隊對人ACE2轉(zhuǎn)基因小鼠進(jìn)行免疫,并用病毒亞變體BA.5.2進(jìn)行攻毒。結(jié)果表明,相比于對照組,ABM5-SNT誘導(dǎo)的免疫反應(yīng)將小鼠肺臟和大腦的病毒滴度載量顯著降低了100倍。隨后SABER在抗體誘導(dǎo)方面的效果評估表明ABM5-SNT在初次免疫和加強(qiáng)免疫中都能有效增強(qiáng)抗體反應(yīng),其佐劑效果與Poly IC和ISCOMs相當(dāng),甚至更優(yōu)。
為了評估ABM5-SNT作為亞單位疫苗佐劑的應(yīng)用潛力,研究團(tuán)隊使用Delta變異株的RBD與抗體Fc融合蛋白(RBD-Fc)與ABM5-SNT進(jìn)行混合免疫。結(jié)果表明,單獨使用RBD-Fc進(jìn)行免疫接種,即使在免疫兩針后也幾乎不會誘導(dǎo)針對野生型RBD的抗原特異性IgG。然而,將RBD-Fc與ABM5-SNT聯(lián)合使用后,免疫一針足以誘導(dǎo)高滴度的針對野生型病毒RBD的特異性IgG。同時,加入ABM5-SNT佐劑可將Delta變異株的RBD-Fc所激發(fā)的對野生型病毒的交叉中和抗體滴度提高10倍以上。在后續(xù)出現(xiàn)的Omicron BA.1和BA.5亞變體上,這一趨勢仍然保留。
SABER可增強(qiáng)抗腫瘤和抗病毒免疫應(yīng)答

SABER具有促進(jìn)“自帶”T細(xì)胞表位的高效提呈和保留了激發(fā)“外帶”亞單位疫苗佐劑效應(yīng)的雙功能
有望為癌癥和傳染病防治
帶來新策略
據(jù)介紹,該研究成果將為個性化腫瘤疫苗和廣譜抗病毒疫苗的研發(fā)提供了新的方向和基礎(chǔ)。其高效的內(nèi)質(zhì)網(wǎng)精準(zhǔn)靶向能力提升了抗原交叉提呈效果,在抗病毒多肽疫苗研究中,僅需針對單一保守表位的CD8+ T細(xì)胞免疫反應(yīng),就可將病毒感染后的病毒載量降低100倍。并且,該技術(shù)不但能夠提升CD8+ T 細(xì)胞免疫反應(yīng),而且兼具增強(qiáng)體液免疫反應(yīng)的佐劑效應(yīng),該佐劑效應(yīng)與現(xiàn)有主要佐劑相當(dāng)甚至更高。因此,有望在未來的臨床應(yīng)用中發(fā)揮重要作用,為癌癥和傳染病的防治帶來新策略。






旦大學(xué).jpg)