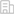隨著人口老齡化加劇,與年齡相關的神經退行性疾病(如阿爾茨海默病、帕金森病)負擔持續上升,而大腦衰老是其最重要的風險因素之一。隨著年齡增長,大腦穩態調控能力逐漸下降,伴隨神經元丟失、神經炎癥增強和蛋白質穩態紊亂等一系列病理生理改變。發現大腦衰老的關鍵生物標志物及其動態演變軌跡,對于理解大腦衰老機制,實現神經退行性疾病的早期診斷和干預具有重要意義,并為腦健康老化提供了新思路。
近日,復旦大學類腦智能科學與技術研究院程煒研究員團隊與復旦大學附屬華山醫院郁金泰教授等團隊展開聯合攻關,基于多模態腦影像與人工智能算法建立量化腦衰老過程的大腦衰老時鐘模型,結合大規模蛋白質組學數據,發現與大腦衰老密切相關的新生物標志物,進一步揭示了大腦衰老的演化模式,發現衰老過程中的顯著波動峰值出現在腦齡57、70和78歲三個關鍵年齡節點。
當地時間2024年12月9日,相關研究成果以《血漿蛋白質組學揭示大腦衰老的生物標志物及動態變化》(Plasma proteomics identify biomarkers and undulating changes of brain aging)為題發表于《自然·衰老》(Nature Aging),并被編輯以《衰老:揭示與大腦衰老相關的關鍵蛋白質》(“Aging: Uncovering key proteins linked to brain aging”)為題,選為研究亮點(Highlight)和媒體發布(Press Release)。

Nature主刊同一天以“How fast is your brain ageing? Proteins in blood offer clues”(《你的大腦衰老有多快?血液蛋白質提供了重要線索》)為題對該研究工作進行重點介紹,認為這項工作“發現了可用于監測大腦衰老的生物標志物,從而為揭示治療癡呆及其他與年齡相關的大腦疾病的方法提供了依據”。

研究團隊基于英國生物銀行數據庫(UK Biobank)隊列中10,949名健康受試者的1,705個多模態磁共振腦影像表型,包括結構磁共振、功能磁共振、磁敏感和彌散張量成像等數據進行建模,利用機器學習算法建立量化大腦衰老進程的衰老時鐘模型(圖1)。進一步將大腦衰老時鐘模型與大規模血漿蛋白質組學(2,920種蛋白)進行關聯分析,發現BCAN,GDF15等13個與大腦衰老關聯的蛋白質,并在隨訪數據中證實了結果的魯棒性。此外,研究團隊進一步通過生信分析發現這些蛋白在應激、組織穩態和神經再生的通路中富集,并在腦組織不同細胞類型中存在特異的表達模式(圖2)。

圖1:課題研究思路
研究者介紹,既往針對衰老的研究往往基于受試者的實際年齡,但此種方法無法全面反映大腦的生物學衰老狀態。該研究采用數據驅動的方式,結合多模態腦影像數據和人工智能算法,成功構建了大腦衰老時鐘模型,相比傳統的實際年齡,這一時鐘能夠更準確地反映大腦的生物學衰老過程。此外,研究團隊還將血漿蛋白質組學數據與腦影像數據結合,數據驅動挖掘出一系列與大腦衰老密切相關的關鍵生物標志物。”

圖2:大腦衰老時鐘模型及2,920種血漿蛋白質與其的關聯
研究團隊進一步探討了這些大腦衰老時鐘相關蛋白對大腦相關表型的影像。通過血漿蛋白質水平與腦結構的相關性分析,發現BCAN和KLK6與額葉、顳葉、海馬等多個皮層和皮層下結構存在顯著關聯,而GFAP主要與白質高信號體積及白質纖維束結構相關(圖3)。
圖3:大腦衰老相關蛋白與腦結構的關聯分析
通過生存分析,研究團隊發現這些血漿蛋白質與未來新發全因癡呆、阿爾茨海默病、血管性癡呆、腦卒中、抑郁等腦疾病的風險存在顯著關聯,其中BCAN濃度每增加1個標準差,全因癡呆風險降低39%,阿爾茨海默病風險降低38%,腦卒中風險降低29%(圖4)。

圖4:大腦衰老相關蛋白與新發腦疾病的生存分析
為進一步刻畫大腦衰老的動態變化過程,研究團隊還繪制了大腦衰老時鐘關聯蛋白隨大腦衰老的變化軌跡,并通過聚類算法識別出這些蛋白呈現六類不同的演變模式,并且近三分之一的蛋白質在腦衰老過程中呈現非線性的變化模式,其水平在腦衰老早期即出現顯著改變,并代表細胞外基質組成、失巢凋亡、細胞-細胞黏附等生物學功能(圖5)。
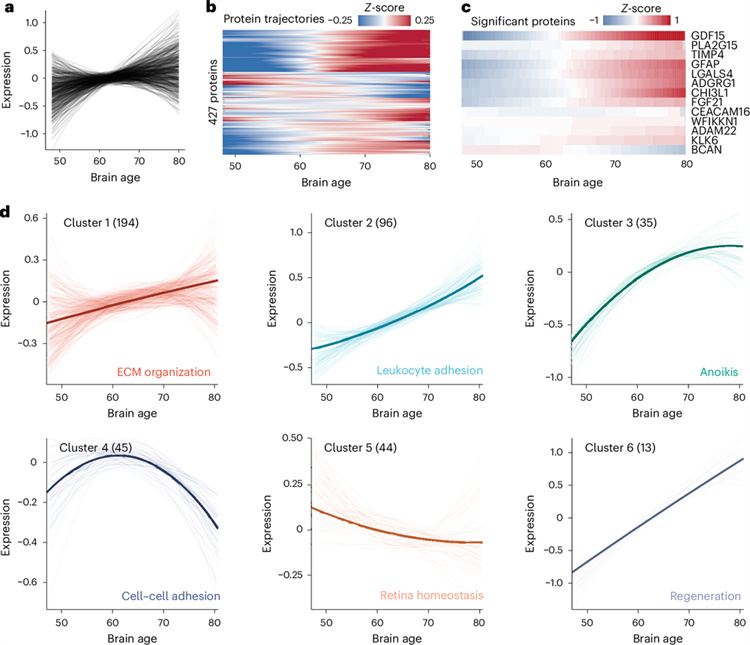
圖5:大腦衰老過程中血漿蛋白質的波動變化
最后,通過差異表達-滑動窗口分析,研究團隊進一步闡明了大腦衰老在57、70和78歲存在3個蛋白質水平變化高峰,可能是“大腦斷崖式衰老”的時間點,其中57歲的高峰主要與代謝過程和精神健康特征有關,70歲的高峰與腦結構和癡呆及卒中等腦疾病的關聯最為顯著,而78歲的高峰與JAK-STAT等炎癥信號通路有關(圖6)。

圖6:大腦衰老過程中差異表達血漿蛋白質高峰及其生物學功能
團隊成員介紹,大腦衰老是復雜的非線性變化過程,在特定年齡階段會出現顯著的“斷崖式衰老”現象。研究結果顯示,腦齡57、70和78歲是大腦功能急劇下降的關鍵節點,而特定蛋白質的急劇變化可能是腦功能快速退化的關鍵驅動因素。這一發現為理解腦衰老的分子機制提供了重要的科學依據,也為腦衰老相關疾病提供了新的生物標志物和潛在治療靶點,不僅有助于實現神經退行性疾病的早期診斷與精準干預,還為制定改善群體腦健康的策略和推動公共衛生干預提供了重要參考。
據悉,復旦大學近年來聚焦AI for Science科學研究范式,該研究即為典型的AI賦能的腦科學研究,通過理工醫交叉融合系統揭示了腦衰老的標志物及其演化規律,不僅深化了人們對衰老機制的理解,也為衰老相關疾病的防治提供了新的科學依據和技術路徑,具有重要的臨床應用價值。
在團隊看來,盡管腦衰老是一個復雜且無法避免的生物學過程,但這項研究有望幫助人們更好地監測和預防腦衰老,從而改善生活質量。未來,通過簡單的外周血檢測,人們或許能夠預測“腦年齡”;通過分析血液中的特定標志物,人們可以估算大腦的實際年齡,這些標志物的變化不僅能反映大腦健康狀況,還能發現腦衰老的早期信號。借助這一方法,人們能夠及時捕捉大腦問題的早期跡象,甚至在癥狀出現之前采取干預措施。通過制定個性化的預防和干預計劃,可有效延緩腦衰老。例如,保持規律運動、均衡飲食、優質睡眠以及良好的壓力管理,都有助于促進大腦更健康地衰老。這些個性化策略不僅能降低認知能力下降的風險,還能顯著提升整體生活質量。
總之,隨著科技的發展,未來人們有望通過更簡單、有效的方式監測大腦健康,并通過量身定制的預防和干預措施,實現健康腦衰老,進一步提升老年生活質量。
復旦大學附屬華山醫院博士生柳偉仕為本文第一作者。復旦大學類腦智能科學與技術研究院程煒研究員,復旦大學附屬華山醫院郁金泰教授、鄭州大學第一附屬醫院許予明教授為論文共同通訊作者。該研究得到了科技創新2030“腦科學與類腦研究”重大項目、國家自然科學基金、國家重點研發計劃、上海市市級科技重大專項等經費支持。