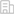DNA N6-甲基腺嘌呤(6mA)近年來在真核生物中陸續被鑒定和發現,成為表觀遺傳學領域的研究熱點。在人、小鼠、線蟲、擬南芥及單細胞的四膜蟲、衣藻和早期分化的真菌中,調控6mA的甲基化酶或去甲基化酶已被系統鑒定和研究,但有關6mA在真核生物中的功能和調控機理的探索才剛剛起步。
2025年1月,學校海洋生物多樣性與進化研究所高珊課題組與南加州大學劉一凡課題組合作在PNAS(《美國科學院院刊》)雜志發表題為“Dual modes of DNA N6-methyladenine maintenance by distinct methyltransferase complexes”(DNA N6-腺嘌呤甲基化酶復合體的雙重調控模式)的研究成果。這項研究以單細胞真核生物-四膜蟲為模式材料,首次發現了兩種不同的6mA甲基化酶復合體,并闡明了它們在維持性甲基化過程中的協同作用。這一雙重調控機制確保了DNA復制后6mA甲基化快速、準確的恢復。
真核生物6mA在基因轉錄調控和染色質結構塑造中發揮著重要作用。團隊前期以單細胞真核模式生物四膜蟲為研究材料,系統解析了6mA的分布模式、甲基轉移酶及其在細胞生長發育中的功能和調控通路,并發現6mA以經典的半保留方式進行穩定遺傳。然而,特異性分布的6mA位點如何精準且高效地傳遞給后代,尚不清楚。
該工作鑒定到了兩種以6mA甲基化酶AMT1為核心的復合體:AMT6復合體和AMT7復合體(圖1A)。兩個復合體在多個方面表現出顯著差異:在甲基化酶活性方面,AMT7復合體相較于AMT6復合體具有更高的酶活和更強的催化連續性(圖1B)。在分布模式方面,AMT7顯示出更強的染色質結合力,并呈現基因區傾向性分布;而AMT6的染色質結合能力較弱,且分布模式無顯著傾向。在體內調控方面,AMT7敲除株系的6mA水平下降明顯,且出現生長緩慢以及巨大伸縮泡等表型,而AMT6敲除株系的上述表型均較為微弱(圖C-D)。值得注意的是,兩個復合體之間存在一定的競爭性關系:AMT1與復合體的另外兩個組分蛋白AMTP1和AMTP2形成一個subcomplex,通過AMT6和AMT7的競爭性組裝形成有功能的完整復合體。
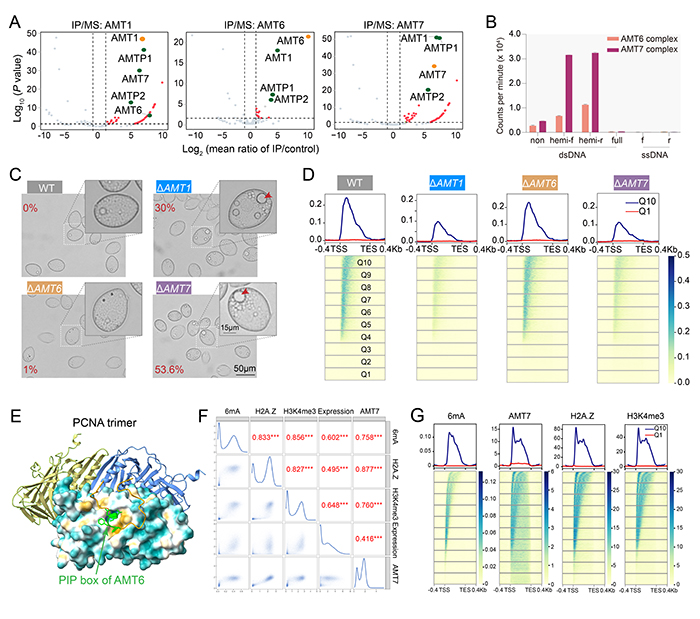
圖1. 兩種不同的6mA甲基化酶復合體(AMT6復合體和AMT7復合體)。(A)6mA甲基化酶復合體組分蛋白AMT1、AMT6及AMT7的IP-MS結果。(B)兩種復合體的酶活檢測。(C)AMT1和AMT7敲除后表現出伸縮泡異常增大。(D)AMT1、AMT6、AMT7敲除后的6mA水平及基因組分布情況。(E)AF3預測顯示PCNA與AMT6在PIP box處相互作用。(F)6mA、AMT7、H2A.Z、H3K4me3及轉錄的相關性分析。(G)6mA、AMT7、H2A.Z及H3K4me3在基因區的分布。
兩個復合體都傾向于催化半甲基化的DNA底物,符合其作為維持性甲基化酶的特征。AMT6復合體被復制關鍵蛋白PCNA招募(圖1E),主要作用是促進DNA復制后維持甲基化的啟動。而AMT7復合體與組蛋白變體H2A.Z和組蛋白翻譯后修飾H3K4me3等表觀遺傳標記密切相關(圖1F-G)。它由這些轉錄相關的表觀遺傳途徑招募,負責絕大多數位點的維持性甲基化。通過分別識別復制和轉錄通路的信號,兩個復合體共同實現6mA位點穩定高效的遺傳。
AlphaFold3預測發現(圖2),AMT6/AMT7復合體與DNA結合后會發生明顯的結構變化,從多變的開放形式轉變為單一的封閉形式(圖2A-F)。在封閉狀態下,復合體呈現由AMT6/AMT7、AMT1和AMTP1共同包裹雙鏈DNA的鉗狀結構(圖2D, F)。兩種復合體的蛋白交聯實驗也證實了這一結果(圖2G-H)。上述結果表明,AMT6/AMT7復合體的維持甲基化涉及多個步驟,從兩種復合體的競爭性組裝開始,到最終形成穩定的封閉結構,從而協同進行6mA甲基化的調控。
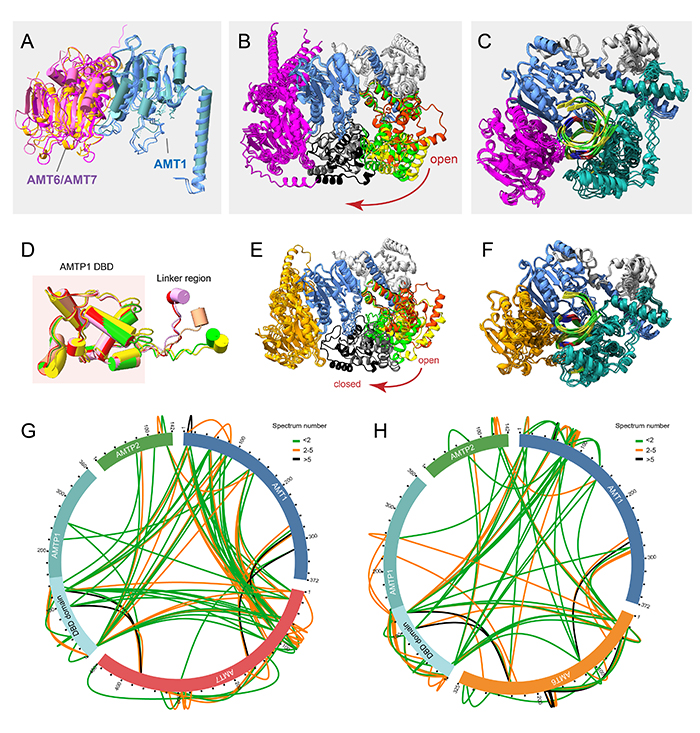
圖2. 兩種6mA甲基化酶復合體的AF3(AlphaFold3)結構預測。(A)AMT6和AMT7復合體的AF3預測模型。(B)AMT7復合體從開放到關閉的動態轉換。(C)AMT7復合體與DNA結合后的穩定狀態。(D)AMTP1的DNA結合結構域(DBD)是穩定的,而接頭區域表現出高度的靈活性。(E)AMT6復合體的從開放到關閉的動態轉換。(F)AMT6復合體與DNA結合后的穩定狀態。(G)AMT7復合體的蛋白交聯結果。(H)AMT6復合體的蛋白交聯結果。
該工作揭示了四膜蟲中的6mA維持甲基化能夠整合來自復制和轉錄的信號,通過雙模式系統進行多重識別實現精確和快速的甲基化。該工作揭示了6mA位點精準且高效地傳遞的機制,解析了轉錄與復制在表觀遺傳調控中的協同作用,進一步推動了我們對甲基化調控機制的理解(圖3)。

圖3. 兩種6mA甲基化酶分工協作的模式圖。

該研究由學校海洋生物多樣性與進化研究所原生動物學團隊高珊課題組與南加州大學劉一凡課題組共同完成。高珊課題組的副教授王媛媛,博士生南北、葉飛、張喆和劉一凡,課題組博士后楊文濤為該文章的共同第一作者。高珊教授、劉一凡副教授和王媛媛副教授為文章的通訊作者。云南大學章文信副教授,青島華大基因研究院王丹彤博士,高珊課題組博士畢業生潘博和段麗麗,博士生魏帆、李海程、牛俊驊、鞠艾利和博士后劉永強對本文亦有重要貢獻。