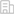圖1.利用轉肽酶介導的復分解反應對組蛋白編輯的示意圖
組蛋白H3的N端翻譯后修飾在調控基因轉錄活性和染色質結構方面發揮著非常重要的功能,其異常修飾可能會導致發育紊亂和癌癥的發生。FDA認證上市的藥物vorinostat和tazemetostat分別通過抑制去乙酰化酶HDAC和甲基轉移酶EZH2的活性治療癌癥,故調控組蛋白修飾對基礎研究和藥物開發都有重要意義。在現有的方法中,密碼子拓展技術和蛋白質反式剪接能夠制備含有特定修飾的組蛋白,但是無法編輯細胞原位的組蛋白;小分子抑制劑和組蛋白修飾酶的融合蛋白雖然能夠調控細胞原位的組蛋白修飾,但是無法精準引入多種修飾。
金黃色葡萄球菌轉肽酶sortase A最早被發現催化特定蛋白共價連接到細胞壁上,然后被逐步開發改造成一類重要的化學工具酶,其介導的連接反應(圖2A)被廣泛應用于蛋白質研究。但是由于該反應的兩個底物末端必須含有轉肽酶所需的識別序列,導致其應用有局限性。在此研究中,作者提出了轉肽酶Sortase介導的復分解反應(圖2B),多肽底物可以含有額外穿膜序列,蛋白底物也可使用全長序列,從而有潛力應用到細胞內編輯蛋白質的修飾。作者初步使用含有sortase識別序列的組蛋白H3L(A29L)以及H3L多肽作為底物成功進行了證實,為利用H3L-R9穿膜肽和轉肽酶編輯組蛋白H3L的N端修飾奠定了基礎(圖2C-D)。

圖2.使用5M-Srt和H3L驗證轉肽酶介導的復分解反應
由于傳統轉肽酶的活性因依賴鈣離子而在細胞核內不適用,作者通過突變改造得到了具有高活性且不依賴于鈣離子的新變體6M-Srt,并在體外驗證了其在核小體上高效的反應活性。6M-Srt通過先將H3L原有的尾巴切掉,然后把帶有特定修飾的底物多肽連接到中間體上的作用方式對核小體的H3L進行編輯,并且陰離子交換色譜證明核小體在此過程中一直保持著結構完整性(圖3)。更進一步,作者使用提取的細胞核證實6M-Srt可以穿過核孔將化學修飾通過復分解反應編輯到染色質上的H3L。
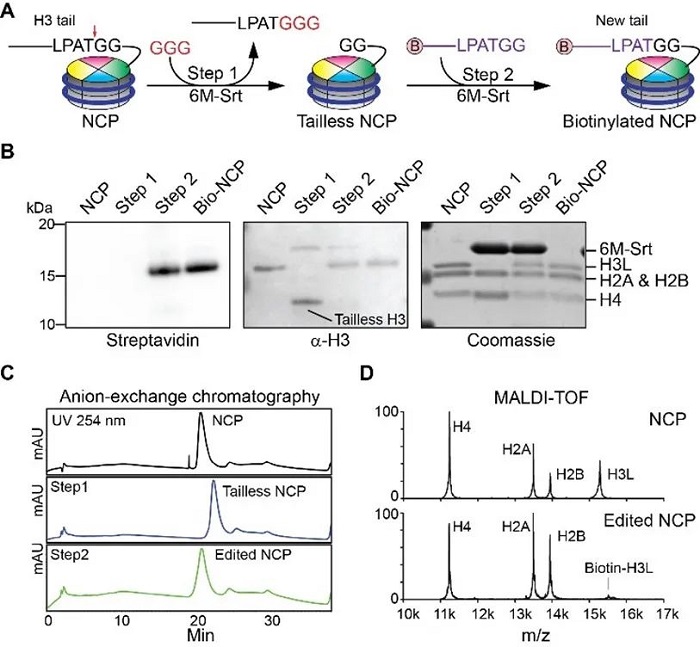
圖3.使用6M-Srt體外對重塑核小體進行修飾編輯
最后,作者利用細胞穿膜肽將帶有特定位點含有生物素、賴氨酸甲基化或賴氨酸巴豆酰化修飾的底物多肽傳遞到活細胞的細胞核中,參與6M-Srt介導的與組蛋白H3L的復分解反應,成功將各種修飾編輯到活細胞的染色質上(圖4A-C)。另外,使用帶有基因沉默修飾的H3K9me3K27me3穿膜肽對穩定表達綠色熒光蛋白的海拉細胞進行編輯后能夠降低細胞的綠色熒光強度(圖4D-E)。
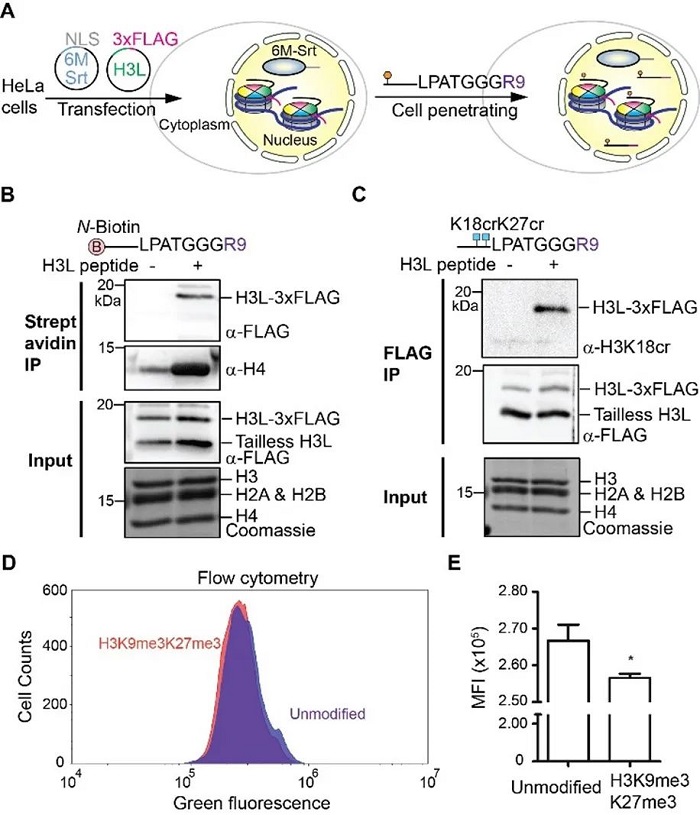
圖4.使用H3L-R9穿膜肽和6M-Srt對活細胞染色質上H3L的修飾編輯
綜上所述,該工作構建了一種全新機制的編輯染色質上組蛋白修飾的方法,能夠實現對活細胞內組蛋白多個位點多種類型修飾的編輯,為開發新一代精準的組蛋白H3翻譯后修飾的編輯方法用以調控基因轉錄活性和表觀遺傳修飾狀態奠定了堅實的基礎。轉肽酶Sortase介導的復分解反應還有望被拓展應用到其他組蛋白的表觀遺傳研究,或者將探針、標簽和熒光基團等分子引入活細胞中用于其他蛋白質的化學生物學研究。
該研究工作得到了國家自然科學基金、西湖大學、西湖實驗室的資助。另外該工作得到了西湖大學分子科學公共實驗平臺,生物醫學實驗技術中心的質譜與代謝平臺、基因組平臺和流式平臺,以及高性能計算中心的支持。該研究還得到了西湖大學生命科學學院馬麗佳課題組提供的幫助。