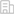Notch通路失調與多種疾病密切相關,包括多種血液系統惡性腫瘤、實體瘤及遺傳病等。盡管目前已有十余種針對Notch信號通路的靶向藥物進入臨床試驗階段,但針對攜帶Notch激活突變的癌癥均收效甚微。特異性靶向活化Notch及其下游轉錄復合物藥物的缺乏與其復雜的轉錄調控機制密切相關。
在Notch信號通路中,DNA結合蛋白RBPJ作為轉錄調節的核心元件,同時具備轉錄抑制和轉錄激活的作用,但是其由抑制向激活轉換的分子機制尚不清楚。僅僅抑制RBPJ蛋白的表達或活性,并不能抑制Notch相關癌癥的進展。有研究報道Notch信號通路可以整合多種上游信號,引起廣泛的細胞命運重編程。這是如何實現的,又是否與目前靶向Notch轉錄復合物遇到的臨床困境相關呢?
2022年9月21日,西湖大學生命科學學院李旭團隊在ScienceAdvances雜志上發表題為FBXO42facilitatesNotchsignalingactivationandglobalchromatinrelaxationbypromotingK63-linkedpolyubiquitinationofRBPJ的研究論文,發現FBXO42通過泛素化RBPJ重塑其先鋒因子功能,引起整體染色質重構,從而引起廣泛的細胞信號響應,填補了長久以來對Notch通路轉錄復合物活性調節知之甚少的領域空白,并可能為將來靶向RBPJ泛素化相關途徑的治療提供指導。
為探究Notch通路轉錄因子RBPJ轉錄活性的轉變機制,研究人員分析了團隊之前發表的人類Notch通路蛋白質互作網絡,發現FBXO42可能是一個重要的Notch通路調節因子。進一步實驗發現FBXO42與RBPJ具有很強的相互作用。FBXO42在Notch激活的T-ALL中高表達,且和Notch通路靶基因的表達呈現較強的正相關。FBXO42作為SCF泛素連接酶復合物的主要成分,參與調節底物蛋白的泛素化降解與信號傳導。研究人員利用FBXO42敲除細胞系,結合泛素化蛋白質組學及相關生化實驗,發現FBXO42通過介導RBPJ上K175的K63鏈型泛素化修飾,促進RBPJ依賴的Notch信號通路的活化。

圖1.FBXO42以K63鏈型泛素化修飾RBPJK175位點
那么泛素化修飾是如何影響RBPJDNA結合能力及轉錄活性的轉變呢,研究人員對野生型及FBXO42敲除細胞進行差異蛋白質組學及表觀遺傳學分析,觀察到FBXO42敲除后RBPJ對染色質修飾蛋白,ATP依賴的染色質重構復合物等的招募作用減弱,染色質結合能力及RBPJ轉錄調節區域的染色質開放性降低,表明RBPJK175位點的泛素化修飾對于RBPJ先鋒因子的功能至關重要。

圖2.FBXO42調節RBPJ轉錄活性

圖3.FBXO42以RBPJ依賴的方式介導廣泛的染色質重構
由于Notch通路異常激活與T-ALL的發生發展密切相關。研究者在多種小鼠血液瘤模型中進一步驗證了FBXO42的生物學功能,結果顯示敲除FBXO42或者是利用小分子抑制劑MLN4924抑制其泛素酶活性均能有效抑制Notch信號的激活,從而緩解腫瘤進程。
綜上所述,研究者利用蛋白質組學及表觀遺傳學研究發現RBPJ具有先鋒因子潛能,可以引起廣泛的染色質重構,從而整合上游信號傳遞到具體的效應蛋白。FBXO42作為Notch信號通路的關鍵調控因子,通過泛素化修飾RBPJ參與轉錄活性轉變及染色質重構的調節,進而影響Notch相關腫瘤的發生發展,揭示其或可作為Notch相關疾病潛在的藥物靶點。

圖4:FBXO42泛素化修飾RBPJ,引起轉錄復合物活性轉變及廣泛的染色質重構