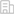人和哺乳動物心肌再生能力缺失和心臟受損后強烈的纖維化反應是心血管疾病治療面臨的瓶頸性問題,實現人類的心臟產生類似于斑馬魚、蠑螈等具有的完全再生能力是科學家們追求的夢想。哺乳動物心肌再生潛能被證實確實存在,但這種能力卻十分有限或處于關閉狀態,難以滿足臨床治療的需要。在發育過程中哺乳動物如何“關閉”心肌細胞再生能力?而重啟心臟再生之門的“鑰匙”又是什么?這些科學問題的回答不僅能解釋哺乳動物心臟發育與再生的基本生命現象,同時也能為心臟疾病的治療探尋可行的方法和策略。近十多年來,心臟再生領域已取得突破性進展,動搖了“哺乳動物心肌細胞是終末分化細胞”的學術論斷。但在大多數時候哺乳動物心肌再生能力依然十分有限,難以滿足臨床疾病治療的需要,找到臨床適用的、有效的誘導內源性心肌細胞增殖和心臟再生的可靠策略仍是重大挑戰。
2022年3月8日,中山大學中山醫學院蔡衛斌教授團隊在期刊Cell Reports發表了題為“Moderate Heart Rate Reduction Promotes Cardiac Regeneration through Stimulation of the Metabolic Pattern Switch”的研究論文,報道了適度降低心率可通過改變心肌細胞的能量代謝模式,誘導心肌細胞增殖并促進心臟再生。
在這項研究中,研究團隊發現乳鼠與成年小鼠的心率與心肌增殖能力呈負相關。進一步對鼠源及人源心肌細胞進行臨床常用降心率藥物的干預,證實在降低心肌細胞原有搏動頻率的10%-20%,可誘導心肌細胞增殖。同時,研究團隊還采用了體外物理電刺激方式改變心肌細胞搏動,以排除藥物自身藥理作用的影響。隨后在三種心肌損傷模型(乳鼠及斑馬魚心尖切除模型、成年鼠急性心肌梗死模型)中進行正反驗證,證實適度降低心率可重啟心肌細胞增殖進而促進損傷心臟的再生性修復。在機制探究中,RNA-Seq結果提示降低心率主要改變了心肌細胞中細胞周期與代謝相關基因的表達。系統性檢測細胞周期變化證實,降低心率主要上調了心肌細胞中Cyclin D1的表達,促進G1/S期轉化,從而誘導心肌細胞重新進入細胞周期。進一步通過細胞能量代謝檢測,結合代謝組學及代謝流分析發現,降低心率使心肌細胞發生能量代謝重編程即能量代謝需求降低,而糖代謝相對增加;一方面糖代謝酶發揮非酶活性促進細胞周期進程,另一方面磷酸戊糖途徑被激活,以滿足增殖心肌細胞所需的生物合成代謝需求,共同促進心肌細胞增殖。該項目揭示了心肌細胞持續節律性搏動、獨特能量代謝模式及有限增殖能力這三大生物學特性的內在聯系,即降低心肌細胞的搏動速率,可影響其能量代謝模式,進而促進心臟再生。
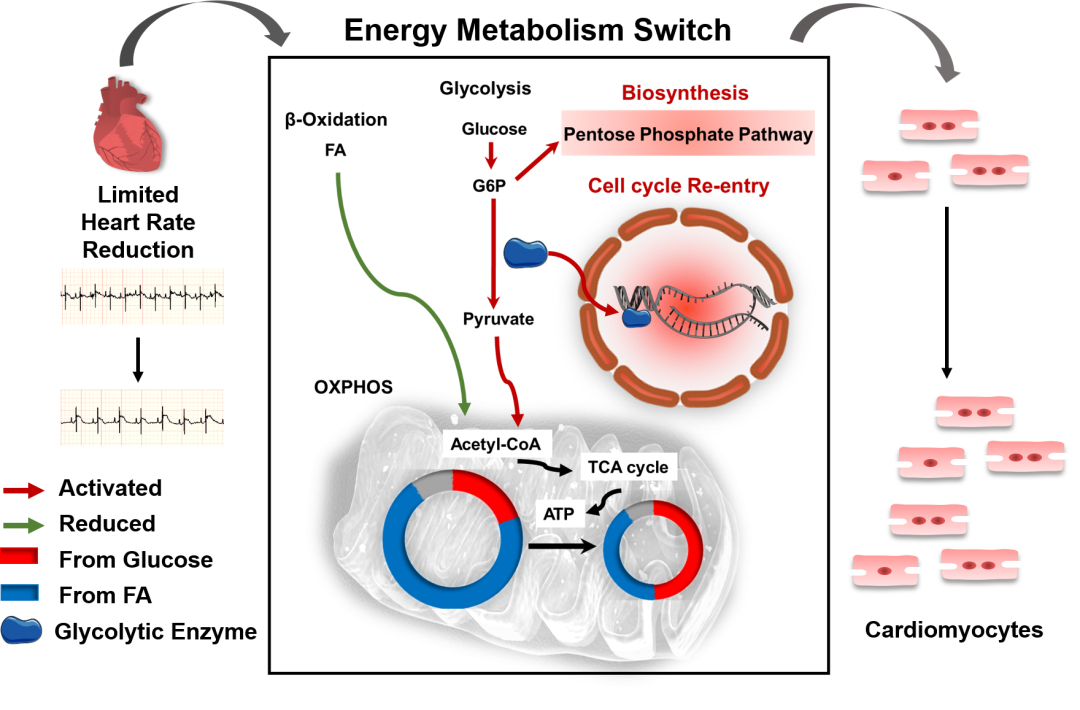
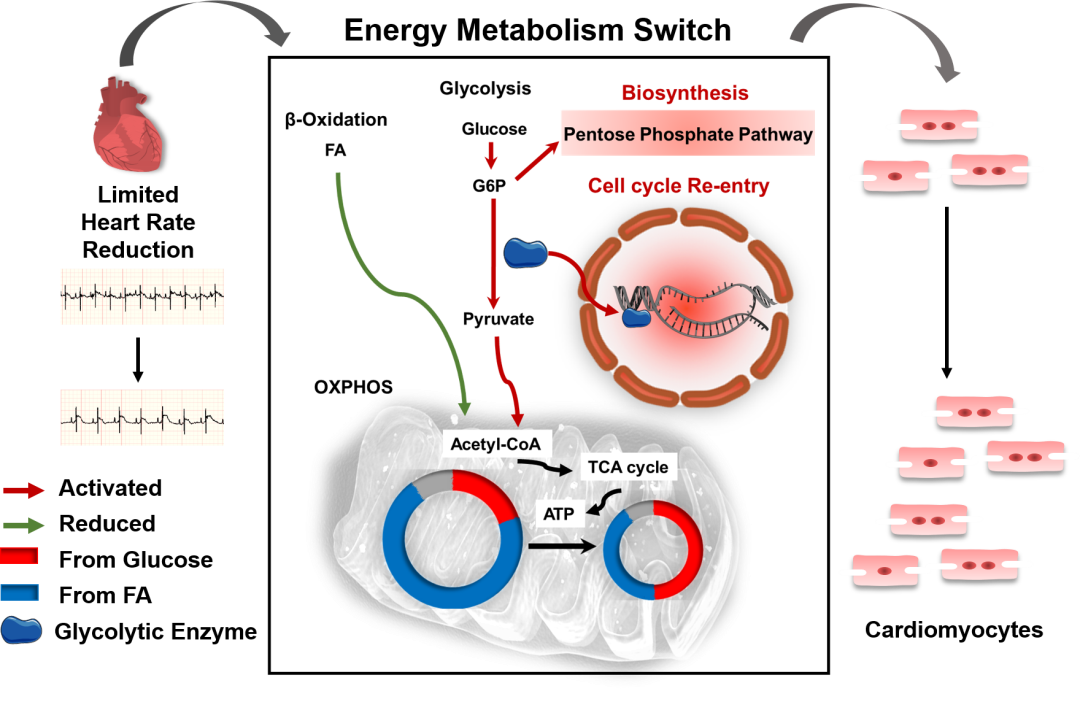
圖注:適度心率降低刺激代謝模式轉換,誘導心肌細胞(CM)增殖,并促進心肌損傷后的心臟再生修復
該研究工作在美國心臟協會基礎心血管科學年會(BCVS2020/AHA)上進行口頭匯報相關結果,受到國際同行關注,并以摘要形式收錄于Circulation Research (2020,https://www.ahajournals.org/doi/10.1161/res.127.suppl_1.338)。
中山大學實驗動物中心和中山醫學院生物化學與分子生物學系蔡衛斌教授、中山醫學院細胞生物學系曹楠教授、中山大學孫逸仙紀念醫院婦產科婦科生殖內分泌專科主任陳慧教授為該論文的通訊作者。中山大學中山醫學院博士后譚靜、2019級博士生楊明為第一作者。該研究受到國家重點研發計劃、國家自然科學基金面上項目、廣東省科技計劃等項目的支持。
論文鏈接:https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00201-7