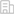利用腸道工程菌及其代謝產物,創制新一代“生物活藥”,用于增強機能、治療疾病,已成為生物醫藥科學領域的前沿研究熱點。其中,如何無創精準在體調控工程菌定植及給藥,一直是工程菌生物醫學應用轉化的難點之一。
天津大學生命科學學院常津團隊王漢杰課題組長期致力于光遺傳學分子生物開關在納米生物學、合成生物學和神經生物學等領域的基礎及應用研究。近日,王漢杰課題組與天津大學化工學院張衛文團隊孫韜合作,在Cell子刊Cell Reports發表了題為“NIR light responsive bacteria with live bio-glue coatings for precise colonization in the gut”的論文,將光遺傳學技術中的光和轉基因光敏蛋白質運用到微生物上,為解決生物活藥工程菌在體有效可控定植提供一種新思路。

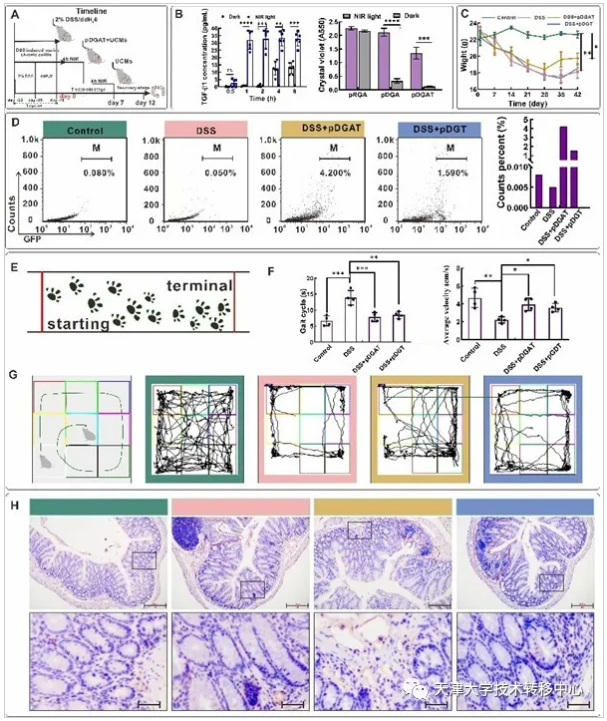
本文利用“納米光遺傳學”技術,構建了一種能夠實現在體腸道靶向精準定植的光響應型生物活藥工程菌,同時對工程菌進行遺傳改造使其分泌抗炎因子,在小鼠模型中證明這種工程菌促進了粘膜的愈合,可改善DSS誘導的慢性結腸炎相關癥狀。
本文要點:
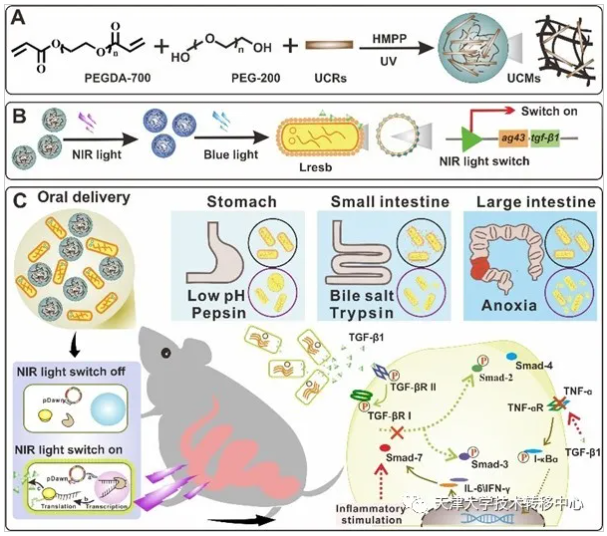
1)基于“納米光遺傳學”技術構建近紅外光光遺傳系統及體外驗證:在工程菌生物活藥的在體應用中,如何實現深層組織的在體給藥調控仍缺乏有效手段。我們利用NIR、UCMs和Lresb構建了近紅外光光遺傳系統,體外證明該系統具備的良好組織穿透性能精準調控工程菌表面展示黏附蛋白和分泌抗炎因子。
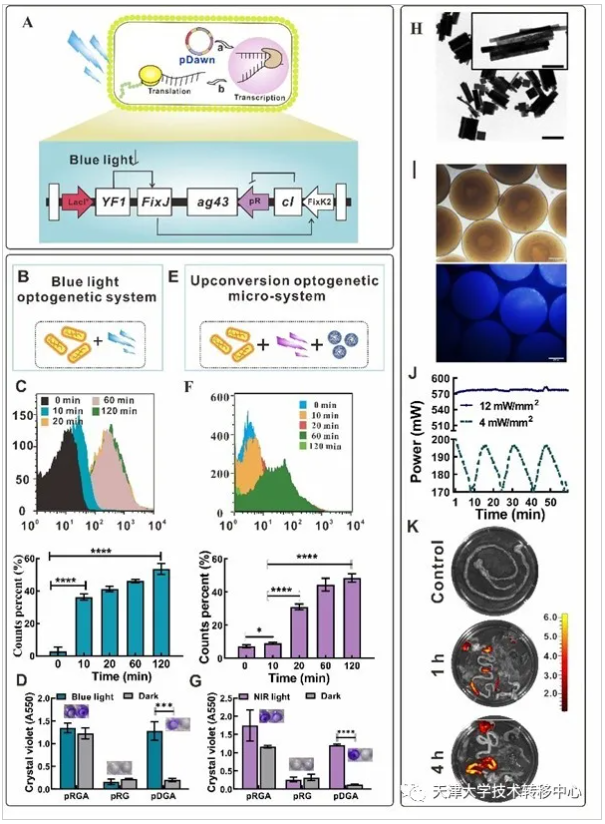
2)基于“納米光遺傳學”技術的光響應生物黏附工程菌實現腸道有效可控定植:我們通過導入光控黏附蛋白模塊來提高工程菌的定植能力。黏附蛋白降低了對親水性基質的親和力進而能夠促進細菌粘附到腸道的黏膜層。
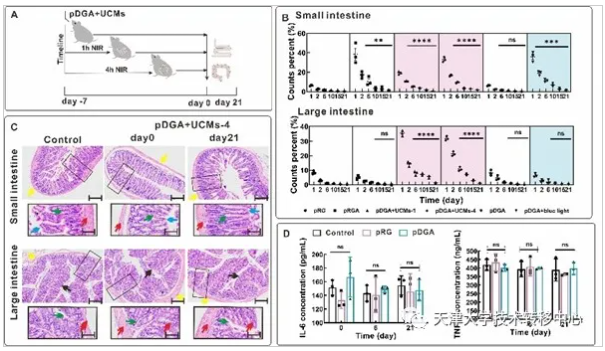
3)基于光響應生物黏附工程菌協同分泌抗炎因子的炎癥性腸病治療:我們使用了E.coli(Nissle 1917)的I型分泌系統,它可以將重組抗炎因子從胞內直接轉移至胞外。在DSS誘導的小鼠慢性結腸炎模型中,從相應病癥的防控角度入手該工程菌實現了對病程的延緩與阻滯。
腸道工程菌參與疾病治療主要從以下兩個方面:一、通過分泌治療因子,作用于腸道細胞表面的受體,或者穿過腸道屏障進入血液作用于其他靶點治療疾病。二、通過引入代謝通路,在腸道將致病因子分解清除,治療疾病。
綜上這項工作不僅為工程菌的可控有效定植提供了新的解決方案,并且在腸道功能紊亂,系統性疾病以及其他器官疾病(腦-腸軸預防、延緩神經疾病)等治療提供了一種長效方案。