很少有疾病能比阿爾茨海默氏癥(AD)更能引起人們的恐懼和無(wú)奈。在過(guò)去的一個(gè)多世紀(jì),研究人員已經(jīng)開(kāi)展了400多項(xiàng)AD藥物臨床試驗(yàn),但迄今為止尚無(wú)一個(gè)治本(阻止疾病進(jìn)程)的藥物可用。究其原因,很重要的一條是AD動(dòng)物模型不能模擬人類AD病人的真實(shí)情況,從而導(dǎo)致有很多候選藥物在動(dòng)物模型中有效,但在AD病人的臨床試驗(yàn)中則無(wú)效。在過(guò)去的25年,科學(xué)家們相繼建立了200多個(gè)AD動(dòng)物模型,但由于設(shè)計(jì)或技術(shù)方面的缺陷,迄今未能獲得一個(gè)真正能夠全面反映人類AD病理表型和疾病機(jī)制的動(dòng)物模型,這在很大程度上妨礙了對(duì)AD的研究和臨床藥物開(kāi)發(fā)。建立人源化、能夠全面模擬人類AD的動(dòng)物模型,一直是AD領(lǐng)域機(jī)制研究和藥物開(kāi)發(fā)亟需解決的一大難題。
近日,由著名神經(jīng)科學(xué)家、清華大學(xué)藥學(xué)院教授魯白領(lǐng)銜的團(tuán)隊(duì),在該領(lǐng)域?qū)崿F(xiàn)了重大突破,成功開(kāi)發(fā)了能夠全面模擬AD的基因敲入大鼠模型,相關(guān)成果日前以長(zhǎng)文的形式在線發(fā)表在《細(xì)胞研究》(CellResearch)期刊上。
大腦中淀粉樣蛋白的沉淀(Aβ)被認(rèn)為是AD病人的主要病理表現(xiàn)和主要病因。而Aβ的前體App基因的一些突變,會(huì)大大加速Aβ沉淀。因此,以往絕大多數(shù)的AD模型,采用各種各樣的轉(zhuǎn)基因技術(shù),將不同突變型的App基因表達(dá)在小鼠中。而轉(zhuǎn)基因技術(shù)有一系列不可避免的的缺陷:將人類App突變基因隨機(jī)插入小鼠的染色體中,可能破壞插入處小鼠自身正常基因的表達(dá);導(dǎo)致基因表達(dá)在錯(cuò)誤的腦區(qū),錯(cuò)誤的細(xì)胞,或者錯(cuò)誤的時(shí)間等;最大的缺陷是導(dǎo)致App的過(guò)量表達(dá)并被酶切成Aβ和一些非生理的蛋白片段,它們會(huì)擾亂小鼠的正常生理功能,導(dǎo)致了與AD無(wú)關(guān)的表型。
在這項(xiàng)研究中,魯白教授團(tuán)隊(duì)刻意避免使用轉(zhuǎn)基因技術(shù),而采用了CRISPR/Cas9基因敲入技術(shù),在大鼠體內(nèi)實(shí)現(xiàn)了人源App基因的替換,同時(shí)攜帶了三個(gè)人類家族突變(AppNL-G-F),而不改變App蛋白及其片段在腦內(nèi)的時(shí)間和空間的表達(dá)水平。系統(tǒng)的病理學(xué),細(xì)胞生物學(xué)和行為學(xué)研究表明,該模型與現(xiàn)有其他AD動(dòng)物模型相比,顯示出與人類AD患者更相似的病理和疾病進(jìn)展。
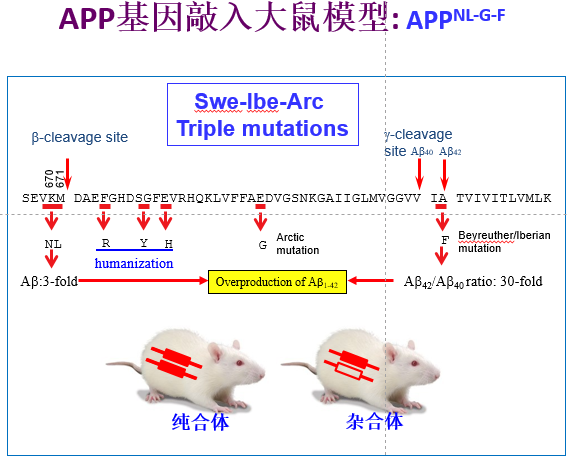
圖1:突變引入到App第16和17外顯子。突變的位點(diǎn)和突變位點(diǎn)的作用在氨基酸序列中進(jìn)行了示意。
據(jù)該論文的第一作者逄克亮博士介紹,在大鼠中實(shí)現(xiàn)人源App基因的替換并同時(shí)進(jìn)行多個(gè)家族突變的原位敲入很具挑戰(zhàn)。由于上述三個(gè)家系突變分布在App基因的兩個(gè)外顯子上,將它們同時(shí)準(zhǔn)確無(wú)誤地敲入基因組并實(shí)現(xiàn)人源化,其成功率很低。公開(kāi)文獻(xiàn)顯示,國(guó)際上有諾貝爾獎(jiǎng)獲得者在內(nèi)的多個(gè)團(tuán)隊(duì)曾試圖進(jìn)行類似App突變的敲入,均未成功。而魯白團(tuán)隊(duì)也是在200多個(gè)App突變敲入大鼠系中,才篩選到了一個(gè)準(zhǔn)確的AppNL-G-F敲入大鼠。
研究人員在對(duì)該AppNL-G-F大鼠中App蛋白和多個(gè)酶切片段進(jìn)行了詳細(xì)分析,發(fā)現(xiàn)人源App基因的替換,既解決了傳統(tǒng)轉(zhuǎn)基因模型常見(jiàn)的Aβ過(guò)表達(dá)和非生理分布缺陷,又避免了基因隨機(jī)插入對(duì)原位基因表達(dá)的破壞性導(dǎo)致的死亡,因此更準(zhǔn)確地模擬了AD大腦中病理發(fā)生機(jī)制。
在AD病人大腦中,有異常高的磷酸化tau蛋白以低聚物纖維形式存在。但在以往幾乎所有的App小鼠模型中都缺少tau病理表型。魯白團(tuán)隊(duì)用4種方法證明,該大鼠模型大腦有類似于人類的高磷酸化的tau,以及病理性tau蛋白聚合物。該結(jié)果揭示了Aβ病理和tau病理其潛在關(guān)系,為Aβ致病假說(shuō)提供了強(qiáng)有力的證據(jù),也為繼續(xù)深入研究其中的機(jī)制提供了方向。
人類AD大腦的第三個(gè)顯著變化是神經(jīng)細(xì)胞的死亡和大腦萎縮(表現(xiàn)為腦室擴(kuò)張)。而以往的AD動(dòng)物模型都不能模擬大腦萎縮這一關(guān)鍵疾病進(jìn)展,即使細(xì)胞死亡也罕有報(bào)道。魯白團(tuán)隊(duì)在AppNL-G-F大鼠中發(fā)現(xiàn)了程序性凋亡和程序性壞死兩種發(fā)生于AD病人中的主要細(xì)胞死亡形式,并隨著疾病的進(jìn)展表現(xiàn)出了腦組織重量減輕和腦室的擴(kuò)張,這也是科學(xué)家首次在人類AD以外的動(dòng)物模型中觀察到腦室的擴(kuò)張。從AD發(fā)現(xiàn)至今100多年,但科學(xué)家們卻一直沒(méi)有找到AD患者神經(jīng)元死亡的確切原因,該AppNL-G-F大鼠為研究這一問(wèn)題提供了工具。
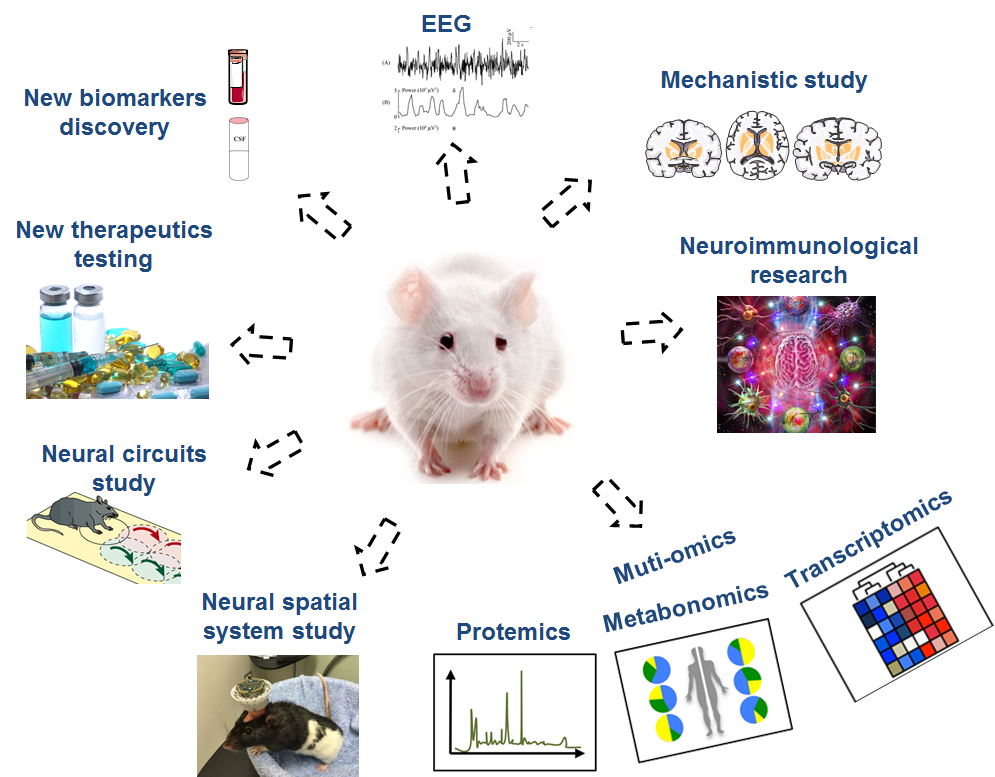
圖2.顯示大鼠模型為研究AD的不同層次的發(fā)病機(jī)制,AD早期診斷的敏感生物標(biāo)記物發(fā)現(xiàn)和創(chuàng)新藥物的療效等,提供了不可或缺的工具
用基因敲入的方法建立AD動(dòng)物模型,并非沒(méi)有被嘗試過(guò)。2014年,日本科學(xué)家Saido研究組用幾乎完全相同的策略,制作了基因敲入型AppNL-G-F小鼠模型。魯教授團(tuán)隊(duì)將其研發(fā)的AppNL-G-F大鼠與Saido的AppNL-G-F小鼠做了頭對(duì)頭的比較研究。一個(gè)令人驚嘆的結(jié)果是,與AppNL-G-F大鼠不同,該小鼠模型欠缺AD患者大腦中的最關(guān)鍵的病理表現(xiàn),即tau蛋白病理、神經(jīng)細(xì)胞的持續(xù)性死亡,及其導(dǎo)致的腦萎縮(表現(xiàn)為腦室擴(kuò)張)。該結(jié)果提示AppNL-G-F大鼠是更接近人類AD的動(dòng)物模型。
此外,研究人員發(fā)現(xiàn)在AppNL-G-F大鼠腦中膠質(zhì)細(xì)胞的顯著活化。尤為重要的是,小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞在Aβ斑塊周圍聚集,這反映了與AD患者大腦類似。其次,發(fā)現(xiàn)該大鼠模型大腦有類似人類AD的突觸損傷和腦區(qū)特征。該AppNL-G-F大鼠動(dòng)物模型的建立,將成為驗(yàn)證目前公認(rèn)的基于突觸修復(fù)的新型治療策略的有效工具。
最后,研究人員通過(guò)多種行為實(shí)驗(yàn)范式,發(fā)現(xiàn)該模型大鼠全方位地出現(xiàn)了人類AD的多種記憶障礙。尤為重要的是,研究人員用一種精巧的更接近于人類行為的觸屏技術(shù),證明AppNL-G-F大鼠具有明顯的情景記憶障礙。情景記憶的缺失是AD患者最早也是最為常見(jiàn)的行為表現(xiàn),但在小鼠模型中應(yīng)用觸屏技術(shù)卻很難。因此,該研究結(jié)果也展示了大鼠AD模型的另一優(yōu)越性。
這項(xiàng)研究由清華大學(xué)藥學(xué)院魯白教授和逄克亮博士發(fā)起并領(lǐng)導(dǎo)。逄克亮博士為該論文第一作者,魯白團(tuán)隊(duì)副研究員郭煒博士為共同通訊作者,聯(lián)合瑞典卡洛琳斯卡醫(yī)學(xué)院佩爾·尼爾森(PerNilsson)研究組、中科院心理學(xué)研究所王瑋文研究組、中科院自動(dòng)化研究所蔣田仔研究組和韓華研究組等多個(gè)科學(xué)家團(tuán)隊(duì)通力合作,歷時(shí)數(shù)載,才成功地建立了全世界領(lǐng)先的AD模型。






