疼痛治療是我國乃至全球范圍內最大的醫療負擔之一。華東師大與華西醫院聯手研究,發現并確證了慢性疼痛治療新靶標,這個“從0到1”的研究為研發原創新藥提供源頭。
華東師范大學生命科學學院陽懷宇課題組攜手四川大學華西醫院蔣若天研究員團隊聚焦于小分子驅動的神經精神疾病新靶標發現和確證研究,發展了基于動態構象的小分子設計方法,用于解決離子通道活性小分子發現這一世界級難題。
從0到1:發現治療慢性疼痛新靶標
疼痛治療是我國乃至全球范圍內最大的醫療負擔之一。在慢性疼痛治療中,嗎啡阿片類藥物具有很強的鎮痛效果,但仍具有諸如耐受及痛覺超敏的副作用。非甾體類抗炎藥也廣泛用于慢性炎性疼痛治療,但鎮痛效果不理想。發現和確證新的鎮痛靶標,從源頭上驅動抗炎鎮痛新藥研發是慢性炎性痛治療的巨大需求。
新靶標發現和確證是醫藥領域從0到1的研究。對化學、藥學、生物學和醫學等多學科的交叉融合有很高的要求,需要運用新方法和新策略。
華東師大生命科學學院陽懷宇課題組攜手四川大學華西醫院蔣若天研究員團隊,在CellResearch雜志在線發表了題為InhibitingHv1channelinperipheralsensoryneuronsattenuateschronicinflammatorypainandopioidsideeffects的研究論文,首次報道了電壓門控質子通道(Hv1)是治療慢性疼痛的新靶標。
Hv1或具有新的神經生物學功能
Hv1屬于電壓門控離子通道超家族,也是結構最簡單的電壓門控離子通道之一。在細胞去極化,胞內質子濃度高于胞外時,Hv1激活可迅速將胞內的質子移送至細胞外。在哺乳動物神經系統中,Hv1是唯一的質子選擇性離子通道。在過去10年里,所有針對神經系統Hv1的研究中,大多局限于小膠質細胞。
研究團隊發現Hv1在小鼠背根神經節(DRG)神經元中表達,并且在急、慢性炎癥刺激或神經元過度興奮后,Hv1表達出現顯著性上調。在人皮膚神經末梢組織中,也發現Hv1的表達。
這一發現提示Hv1或具有新的神經生物學功能。
離子通道類蛋白非常缺乏選擇性藥理工具。Hv1通道體系小,開發抑制劑還面臨額外困難。之前報道了鋅離子和胍類衍生物可以抑制Hv1通道,但由于缺乏Hv1特異性藥理工具,目前大多數Hv1功能研究中,都依賴基因敲除動物(Hv1敲除鼠)及非選擇性抑制劑。
陽懷宇團隊曾揭示靶向離子通道中間態可用于發現抑制劑。借鑒該非經典調控策略,在本研究中研究團隊設計得到靶向Hv1通道動態中間態的抑制劑YHV98-4。電生理實驗顯示該化合物對Hv1具有高度選擇性。
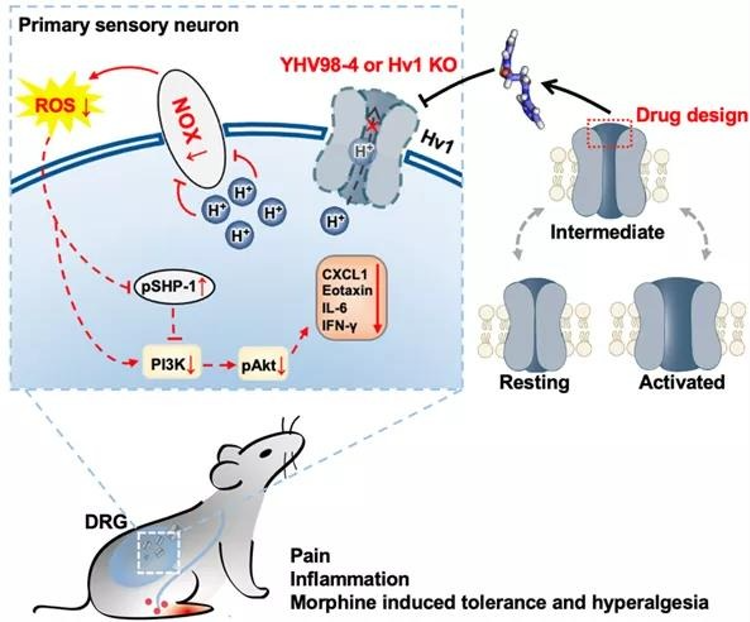
研究人員利用新的抑制劑、Hv1KO小鼠以及AAV病毒介導的背根神經節感覺神經元上Hv1的特異性敲減策略,分離、鑒定和評估了正常與炎癥條件下DRG神經元上Hv1介導的質子電流,發現在炎癥狀態或神經病理性疼痛狀態下,Hv1介導的質子電流均顯著上調。
意外的是,Hv1在神經元中質子電流特性與其在小膠質細胞中的電流特性在動力學方面有顯著差異。接下來,通過質子成像技術揭示了Hv1在DRG神經元質子穩態維持中扮演重要角色:發現抑制Hv1可以緩解慢性疼痛下背根神經節感覺神經元的胞內pH堿化,進而抑制NOX依賴的ROS生成。
抑制Hv1可有效緩解病理性疼痛
為了進一步驗證Hv1參與了慢性炎癥及疼痛的發展,在動物水平實驗中,作者聯合藥理、Hv1全基因敲除及DRG神經元Hv1特異性敲減的手段,發現抑制Hv1可以有效緩解病理性疼痛,改善炎癥狀況。同時,作者也揭示了抑制Hv1可以通過修復受損的ROS-SHP-1-PI3K/pAKT-CXCL1通路達到抗炎效果。
由于ROS及CXCL1均參與嗎啡引起的耐受及痛覺過敏等不良反應,作者猜想Hv1可能參與嗎啡引起的上述不良反應。接下來,作者利用藥理抑制及DRG神經元Hv1敲減,發現抑制Hv1的確可以有效緩解嗎啡使用帶來的副作用及降低ROS產生。
該研究首次報道了Hv1在神經系統中新的細胞類型中的新功能,并開發了首批具有良好選擇性且具有invivo應用潛力的Hv1抑制劑,并結合其他手段,揭示了Hv1可能是潛在的慢性疼痛治療及改善嗎啡引起的不良反應的新靶標。
該研究以華東師范大學為第一單位,與四川大學華西醫院合作完成。蔣若天研究員和陽懷宇教授為該論文共同通訊作者,華東師大張乾森副研究員、四川大學華西醫院任益民、華東師大莫奕青及郭佩佩和四川大學華西醫院廖萍及羅運成為共同第一作者。






